هيليوم من ويكيبيديا، الموسوعة الحرة
ليثيوم → هيليوم ← هيدروجين
↑
He
↓
Ne
2He
الاسم، العدد، الرمز هيليوم، 2، He
تصنيف العنصر غاز نبيل
المجموعة، الدورة، المستوى الفرعي 18، 1، s
الكتلة الذرية 4.0026 غ·مول−1
توزيع إلكتروني 1s2
توزيع الإلكترونات لكل غلاف تكافؤ 2 (صورة)
الخواص الفيزيائية
الطور غاز
الكثافة (0 °س، 101.325 كيلوباسكال)
0.1786 غ/ل
كثافة السائل عند نقطة الانصهار 0.145 غ·سم−3
نقطة الانصهار (عند 2.5 ميغاباسكال) 0.95 ك، −272.20 °س
نقطة الغليان 4.22 ك، −268.93 °س
النقطة الحرجة 5.19 ك، 0.227 ميغاباسكال
حرارة الانصهار 0.0138 كيلوجول·مول−1
حرارة التبخر 0.0829 كيلوجول·مول−1
السعة الحرارية (عند 25 °س) 20.786 جول·مول−1·كلفن−1
ضغط البخار
ض (باسكال) 1 10 100 1 كيلو 10 كيلو 100 كيلو
عند د.ح. (كلفن) 1.23 1.67 2.48 4.21
الخواص الذرية
الكهرسلبية لا بيانات (مقياس باولنغ)
طاقات التأين الأول: 2372.3 كيلوجول·مول−1
الثاني: 5250.5 كيلوجول·مول−1
نصف قطر تساهمي 28 بيكومتر
نصف قطر فان دير فالس 140 بيكومتر
خواص أخرى
البنية البلورية نظام بلوري سداسي مرصوص
المغناطيسية مغناطيسية معاكسة
الناقلية الحرارية 0.1513 واط·متر−1·كلفن−1 (300 كلفن)
سرعة الصوت 972 متر/ثانية
رقم الكاس 7440-59-7
النظائر الأكثر ثباتاً
المقالة الرئيسية: نظائر الهيليوم
النظائر الوفرة الطبيعية عمر النصف نمط الاضمحلال طاقة الاضمحلال MeV ناتج الاضمحلال
3He 0.000137%* 3He هو نظير مستقر وله 1 نيوترون
4He 99.999863%* 4He هو نظير مستقر وله 2 نيوترون
*القيم حسب الوفرة في الغلاف الجوي، لكنها يمكن أن تكون غير ذلك خارجه
الهيليوم هو عنصر كيميائي له الرمز He وله العدد الذري 2. يقع الهيليوم في الجدول الدوري ضمن عناصر الدورة الأولى وعلى رأس عناصر المجموعة الثامنة عشر. في الظروف القياسيّة من الضغط ودرجة الحرارة فإنّ الهيليوم عبارة عن غاز عديم اللون والرائحة، غير سام وليس له مذاق. ينتمي الهيليوم إلى الغازات النبيلة لذلك فهو غاز خامل أحادي الذرة، وبسبب خموله الكيميائي لا توجد جزيئات له، فهو يوجد دائماً في صورته الذريّة. للهيليوم أقلّ درجة غليان وانصهار مقارنةً ببقيّة العناصر الكيميائيّة، وهو يوجد أغلب الأحيان في الحالة الغازيّة باستثناء ظروف خاصة جداً.
يعدّ الهيليوم ثاني أخفّ العناصر في الكون بعد الهيدروجين، كما أنه ثاني أكثر العناصر وفرةً في الكون، حيث يشكّل 24% من الكون بالنسبة لكتلة العناصر. بالنسبة لوفرته على الأرض فإن الهيليوم نادر الوجود طبيعيّاً، حيث يشكّل فقط 5.2 جزء من المليون بالنسبة للغلاف الجوي. للهيليوم عدّة نظائر لكنّ أكثر من 99% من الهيليوم على الأرض هو هيليوم-4، والذي تتألّف نواته من بروتونين ونيوترونين اثنين.
يوجد غاز الهيليوم في بعض حقول الغاز الطبيعي بنسبة تصل إلى 7% حجماً، حيث يستخرج من هناك بواسطة التقطير التجزيئي. تجدر الإشارة إلى أن مصادر الهيليوم قابلة للنفاد، حيث أنّه العنصر الوحيد الذي لديه سرعة إفلات، أي أنه عندما يطلق في الغلاف الجوي فإنه يتسرّب إلى الفضاء الخارجي.
يستخدم الهيليوم في تقنيّات التبريد العميق، وخاصة لتبريد أجهزة المغناطيس فائق الموصليّة المستخدمة في تقنيّات التصوير بالرنين المغناطيسي. كما يستفاد من الخواص الخاملة لغاز الهيليوم في استعماله كغاز واقي في اللحام القوسي وفي عمليات تصنيع رقائق السيليكون.

بيير جانسين
يعد الهيليوم العنصر الوحيد الذي اكتشف في الكون وذلك على الشمس قبل أن يكتشف على الأرض. حدث ذلك عندما لاحظ الفلكي بيير جانسين وجود خط أصفر لامع في طيف الإصدار للغلاف اللوني للشمس أثناء حادثة كسوف كلّي للشمس في الهند عام 1868. في ذات العام لاحظ الفلكي جوزيف نورمان لوكير نفس الخط الأصفر من الطيف الضوئي للشمس، وأسماه خط فراونهوفر D3، لأن له طول موجة مقداره 587.49 نانومتر وهو قريب من خطوط D1 و D2 للصوديوم. بعد ذلك، استنتج لوكير أن الخط الطيفي هذا سببه عنصر موجود في الشمس وغير موجود على الأرض، فأطلق عليه سويّة مع إدوارد فرانكلاند الاسم الإغريقي للشمس ἥλιος هيليوس.
في عام 1895، استطاع العالم البريطاني وليام رامزي أن يعزل الهيليوم على الأرض، عندما قام بمعالجة معدن الكليفيت (وهو معدن مشابه لليورانينيت مع وجود حوالي 10% من العناصر الأرضية النادرة) وذلك بأحماض معدنيّة. توقع رامزي وجود الأرغون، ولكنه بعدما قام بفصل النيتروجين والأكسجين من الغازات المتحرّرة من أثر حمض الكبريتيك، لاحظ وجود خط أصفر مميّز في طيف إصدار المادّة المستخرجة، والذي يشبه خط D3 في طيف الشمس، وشخّصت هذه العيّنات على أنّها هيليوم من قبل لوكير والفيزيائي البريطاني وليام كروكس.في تجربة منفصلة قام العالم بير تيودور كليفه مع مساعده أبراهام لانغليت بجمع عينات من غاز الهيليوم من معدن الكليفيت في جامعة أوبسالا في السويد وذلك من أجل تحديد كتلته الذريّة.

وليام رامزي
اكتشافات علميّة
في عام 1907، أظهر العالم إرنست رذرفورد مع توماس رويدز أن جسيم ألفا هو نواة الهيليوم، وذلك من خلال قيامه بالسماح لجسيمات ألفا أن تخترق جدار زجاجي رقيق لأنبوب التفريغ، مما أدّى إلى حدوث تفريغ للشحنة والذي سمح بدراسة طيف الغاز في الداخل.
سُيّل الهيليوم لأول مرّة على يد الفيزيائي هايك كامرلينغ أونس عام 1908، وذلك بتبريد الغاز لأقل من درجة كلفن واحدة حاول أونس الحصول على الحالة الصلبة من الهيليوم بتخفيض درجة الحرارة، لكنه لم يتمكّن من ذلك، لأنه لا توجد للهيليوم نقطة ثلاثية يكون عندها توازن بين الحالات الثلاثة للمادة. بالرغم من ذلك، تمكّن تلميذ أونس الفيزيائي فيليم هندريك كيسوم من تصليب 1 سم3 من الهيليوم بتطبيق ضغط إضافي عند درجات حرارة منخفضة وذلك عام 1926.
في عام 1938، اكتشف الفيزيائي بيوتر كابيتسا أن النظير هيليوم-4 عديم اللزوجة تقريباً في درجات قريبة من الصفر المطلق، وهي الظاهرة التي تعرف اليوم بالميوعة الفائقة. في عام 1972، لوحظت نفس الظاهرة لدى النظير هيليوم-3 وذلك من قبل الفيزيائيّين دوغلاس أوشيروف وديفد لي وروبرت ريتشاردسون، وحازوا بذلك جائزة نوبل في الفيزياء عام 1996.
الاستخراج والاستخدام
اكتشف وجود غاز الهيليوم مع الغاز الطبيعي في الأرض بكميات كافية للإنتاج عام 1903 أثناء التنقيب عن النفط في ديكستر في ولاية كانساس الأمريكية، حيث جمعت كمية من غاز غير قابل للاشتعال. بإجراء عملية تحليل للعيّنة في جامعة كانساس وجد أن الغاز يتألّف من 72% نيتروجين و 15% ميثان و1% هيدروجين و12% من غاز لم يتعرّف عليه حينئذ. بإجراء عملية بحث أعمق وجد هاميلتون كادي و ديفد ماكفارلاند من جامعة كانساس أن 1.84% من العيّنة عبارة عن غاز الهيليوم. أظهرت هذه الأبحاث أنّه على الرغم من ندرة وجود الهيليوم على الأرض فإنّه يتركّز تحت السهول الكبرى بكميّات كبيرة كافية كناتج ثانوي في عملية استخراج الغاز الطبيعي.
هذه الوقائع جعلت من الولايات المتحدة أكبر مزوّد للهيليوم، وجرى الاستفادة من ذلك في الحرب العالميّة الأولى في تعبئة المناطيد الحاجزة بغاز أخف من الهواء مثل الهيدروجين، لكنّه غير قابل للاشتعال. بناءً على ذلك جرى استعمال الهيليوم في تجهيز المناطيد العسكريّة. أوّل منطاد استعمل لهذا الغرض سمّي U.S. Navy's C-7 وأقلعت أول رحلة تجريبيّة له من هامبتون رودز في ولاية فيرجينيا إلى قاعدة بولينغ فيلد العسكريّة في واشنطن في الأوّل من ديسمبر عام 1921. استمرّ استخدام الهيليوم في المجال العسكري حتى الحرب العالميّة الثانيّة في عمليّات اللحام القوسي من أجل التجهيزات العسكريّة واستخدم كغاز لكشف التسريبات في عملية الانتشار الغازي أثناء تخصيب اليورانيوم لتصنيع القنبلة الذريّة في مشروع مانهاتن.
الوفرة الطبيعيّة

على الرغم من ندرته على سطح الأرض فإن الهيليوم يعدّ ثاني أكثر العناصر بعد الهيدروجين وفرة في الكون مشكّلاً 23% من كتلته الباريونيّة. تشكّلت هذه الكميّة الهائلة من الهيليوم بعد فترة قليلة من الانفجار العظيم. يتشكّل الهيليوم في النجوم نتيجة الاندماج النووي للهيدروجين في تفاعل بروتون-بروتون المتسلسل ودورة كربون-نيتروجين-أكسجين (دورة CNO)، والتي تعدّ جزءاً من تفاعلات الانصهار النجمي.
إنّ تركيز الهيليوم في الغلاف الجوي للأرض يعادل 5.2 جزء في المليون، وهو يتركّز في طبقات الجو العليا من غلاف الأرض الجوي.هذا التركيز الضئيل ثابت نسبياً في الغلاف الجوّي رغم الإنتاج المستمرّ للهيليوم، ويعود ذلك إلى انفلات الغاز من الغلاف الجوّي للأرض إلى الفضاء الخارجي وذلك بعدّة آليّات مقترحة.
يدخل الهيليوم في تركيب الغلاف الغازي للعديد من الكواكب بنسب تظهر في الجدول التالي:
نبتون 19 % ± 3.2 %
أورانوس 15.2 % ± 3.3 %
المشتري 10.2 %
زحل 3.25 %
الزهرة 12 جزء في المليون
الأرض 5.2 جزء في المليون
إنّ معظم الهيليوم الموجود على الأرض هو نتيجة الاضمحلال الإشعاعي للعناصر الثقيلة نتيجة إطلاق جسيمات ألفا 2+He، والتي تتجمّع إلكتروناتها لتشكّل الهيليوم عندما تصطدم بالغلاف الصخري. لذلك يوجد الهيليوم بكميّات كبيرة نسبياً في تركيب عدّة معادن لليورانيوم والثوريوم بسبب إطلاقها لجسيمات ألفا أثناء اضمحلالها الإشعاعي مثل اليورانينيت (خاصةً الكليفيت، وهو أحد مشتقّات اليورانيتيت) والكارنوتيت والمونازيت. على هذا الأساس ينتج سنوياً حوالي 3000 طن متري من الهيليوم عبر غلاف الأرض الصخري. إنّ تركيز الهيليوم في القشرة الأرضية هو 8 جزء في البليون، وفي مياه البحار فقط حوالي 4 جزء في الترليون. توجد كمّيّات قليلة من الهيليوم في الينابيع المعدنيّة والغازات البركانيّة والأحجار النيزكيّة.
إنّ المصدر الطبيعي الأكبر للهيليوم هو وجوده في بعض آبار الغاز الطبيعي نتيجة احتباسه تحت الطبقات الصخريّة للأرض. تختلف التراكيز حسب المواقع من عدّة أجزاء في المليون إلى حوالي 7% حجماً من كميّة الغاز المستخرجة كما في حقل الغاز في مقاطعة سان خوان في نيومكسيكو.
الإنتاج
ينتج غاز الهيليوم بشكلٍ صناعي بعملية التقطير التجزيئي للغاز الطبيعي، والذي يمكن أن يوجد بنسبة تصل حتى 7% حجماً.بما أن للهيليوم نقطة غليان أقلّ من أيّ عنصر كيميائي آخر، فإنّ تطبيق درجات حرارة منخفضة عند ضغوط مرتفعة يؤدي إلى تسييل الغازات الأخرى مثل النيتروجين والميثان. بعد ذلك تجري عملية تنقية لغاز الهيليوم بالتعريض المتتالي لدرجات حرارة منخفضة بحيث يضمن عدم بقاء أي أثر لغازات أخرى. كخطوة نهائية للتنقية يستعمل الفحم المنشّط مما يعطي نقاوة تصل إلى 99.995% وتدعى بنقاوة من الدرجة A إنّ الشائبة الرئيسيّة في الهيليوم من الدرجة A هو غاز النيون. في مرحلة الإنتاج النهائيّة يسيّل الهيليوم من خلال عمليات تبريد عميقة بحيث يكون على شكل هيليوم سائل، ممّا يسهّل من عملية النقل، حيث أن حاوية نقل الهيليوم كسائل تسع أكثر بخمسة أضعاف الحجم الذي تنقله حاويات الهيليوم كغاز.
تعدّ الولايات المتّحدة الأمريكيّة أكبر منتج لغاز الهيليوم حيث أتت مرحلة كانت تنتج فيها أكثر من 90% من الاحتياج العالمي لهذا الغاز، وما تبقى تنتجه محطّات توجد في كندا وبولونيا وروسيا، بالإضافة إلى عدّة دول أخرى. إنّ معظم الهيليوم المستخرج في الولايات المتّحدة هو من حقل هيوغوتون للغاز في ولاية كانساس، بالإضافة إلى حقول أخرى في أوكلاهوما وفي حقل بانهاندل في تكساس. للهيليوم استهلاك كبير في الولايات المتّحدة، ومنذ أوائل القرن العشرين فإن للولايات المتّحدة مخزون وطني من هذه الخامة. قُدّر استهلاك الولايات المتحدة من غاز الهيليوم عام 2000 بحوالي 15 مليون كغ سنوياً. في منتصف التسعينات افتتحت محطّة جديدة لتوليد الهيليوم في مدينة أرزيو الجزائريّة لها القدرة على إنتاج 17 مليون متر مكعّب من غاز الهيليوم مما يغطّي الطلب الأوروبي من الهيليوم في السوق العالمي. وبين عامي 2004 و 2006 افتتحت محطّتان جديدتان لإنتاج الهيليوم وذلك في رأس لفان في قطر وفي مدينة سكيكدة في الجزائر. مع افتتاح محطّة سكيكدة أصبحت الجزائر ثاني منتج للهيليوم في السوق العالمي. حسب إحصاءات أجريت عام 2008، فقد استخرج حوالي 169 مليون متر مكعّب من الهيليوم من الغاز الطبيعي وذلك بنسبة 78% من الولايات المتحدة الأمريكية و10% من الجزائر ومعظم ما تبقّى تنتجه دول متعدّدة على رأسها روسيا وبولونيا وقطر.
إنّ ازدياد الطلب العالمي على الهيليوم ومحدوديّة الإنتاج أدّيا إلى ارتفاع سعر إنتاج الهيليوم في العالم، بحيث أنه بين عامي 2002 و 2007 ازداد سعر الهيليوم بمقدار الضعف. نتيجة محدوديّة موارد الهيليوم تجري حالياً استخدام تقنيّات يطبق فيها انتشار للغاز الطبيعي الخام عبر أغشية نصف نفوذة من أجل استرجاع وتنقية الهيليوم.
النظائر
لتفاصيل أكثر عن هذا الموضوع، انظر نظائر الهيليوم.
هنالك تسعة نظائر معروفة للهيليوم، اثنان منها فقط عبارة عن نظائر مستقرّة وهي هيليوم-4 4He وهيليوم-3 3He. يعدّ النظير هيليوم-4 هو النظير الطبيعي الأكثر وفرةً حيث أن 99.99986% من عنصر الهيليوم في الطبيعة هو هيليوم-4، وما تبقّى فهو هيليوم-3. إحصائيّاً هنالك ذرّة هيليوم-3 واحدة مقابل مليون ذرّة هيليوم-4. ينتج النظير هيليوم-4 في الأرض كناتح لعمليّة اضمحلال ألفا للعناصر المشعّة الأثقل حيث تنتج جسيمات ألفا، والتي هي عبارة عن نوى هيليوم مشحونة. تتميّز نواة النظير هيليوم-4 بثباتيّة عاليّة لأن نويّاتها مرتّبة بشكل كامل في غلافها النووي. إنّ الكميّات النادرة للنظير هيليوم-3 موجودة في الطبيعة منذ نشأة الأرض، بالإضافة إلى هبوط كمّيّات مصدرها من الكون، والتي كانت محتجزة ضمن الغبار الكوني، كما تنتج كمّيّات قليلة من الهيليوم-3 من اضمحلال بيتا للتريتيوم.
خواص النظائر 3He 4He
الطاقة الساكنة (ميغا إلكترون فولت) 2809 3728
الكثافة كغ/م3 0.134 0.178
درجة الحرارة الحرجة (كلفن) 3.32 5.20
نقطة لامدا (كلفن) 0.0025 2.1768
الضغط عند الانصهار (ميغا إلكترون فولت) عند 0 كلفن 3.439 2.536
نقطة الانصهار (كلفن) 3.19 4.21
إنّ تفاوت نسبة النظيرين هيليوم-3 وهيليوم-4 في الصخور يستخدم من أجل تحديد عمر الصخور ومعرفة أصل منشأها في الغلاف الصخري للأرض. إنّ نسبة النظير هيليوم-3 3He إلى هيليوم-4 4He في الكون أعلى منها على الأرض بحوالي 100 مرّة وذلك في الوسط بين النجمي.كما أنّ وفرته في النجوم كبيرة نسبياً نتيجة الاندماج النووي. إنّ المواد الكونيّة مثل الحطام الصخري للأقمار والأحجار النيزكية تحوي أيضاً نسب من هيليوم-3، والتي اصطحبتها الرياح الشمسيّة، كما أنّ سطح القمر يحوي الهيليوم-3 بتراكيز أعلى منها على سطح الأرض.
إنّ مزيج من كمّيّتين متساويتين من 3He و 4He السائل تحت 0.8 كلفن سينفصل إلى طبقتين غير مزوجتين وذلك نتيجة لتباين الإحصاءات الكموميّة لهما، حيث أن 4He عبارة عن بوزون، في حين أنّ 3He فرميون. يستفاد من خاصة عدم امتزاج هذين النظيرين في ثلاجة التمديد، حيث يمكن استخدام هذا التطبيق للحصول على درجات حرارة بحدود بضعة ميلي كلفن.
الخواص الفيزيائيّة
الهيليوم في ميكانيكا الكم

تمثيل لذرّة الهيليوم تظهر فيه نواة ذرّة الهيليوم في المنتصف وحولها السحابة الإلكترونيّة.
من منظور ميكانيكا الكم فإنّ الهيليوم ثاني أبسط ذرّة يمكن إجراء نموذج لها بعد ذرّة الهيدروجين. يتألّف الهيليوم من نواة تتألّف من بروتونين ونيوترونين اثنين، يحيط بهما إلكترونين اثنين في مداراتها الذريّة. حسب ميكانيك نيوتن التقليدي فإنه من غير الممكن تقديم حل رياضي تحليلي لنظام يتألّف من أكثر من جسيمين اثنين، وذلك حسب معضلة الأجسام الثلاث. بناءً على ذلك، تستخدم وسائل رياضيّة عدديّة عن طريق الكيمياء الحاسوبية لوضع نموذج ميكانيكي كمّي لارتباط إلكترونات الهيليوم بالنواة. رغم بساطة نموذج النواة ظاهرياً فإن معادلات معقّدة ضروريّة لوضع محاكاة لنموذج الذرّة الحقيقي.
أطوار الهيليوم
إنّ الهيليوم في الأحوال العادية عبارة عن غاز، وعند درجات حرارة منخفضة عند نقطة انصهاره يصبح بالطور السائل. إلا أنّ الهيليوم هو العنصر الوحيد الذي لا يمكن الحصول على الطور الصلب منه تحت ظروف الضغط العادي. يجب رفع الضغط إلى قيم تصل نحو 2.5 ميغا باسكال عند درجات حرارة منخفضة جداً (أقل من 1.5 كلفن أي ما يعادل −272 °س).
يشكّل الهيليوم الصلب بلّورات ولكن لا يمكن فصل الهيليوم الصلب عن السائل بصريّاً، لأن قرينة الانكسار لهما متقاربة جداً. للهيليوم الصلب قابلية انضغاط عالية، بحيث أنه من الممكن مخبريّاً إنقاص حجمه بأكثر من 30%. تبلغ كثافة الهيليوم الصلب 0.214 ± 0.006 غ/سم3 عند 1.15 كلفن و 66 جو، والكثافة المتوقعة عند 0 كلفن وضغط قدره 25 بار هي 0.187 ± 0.009 غ/سم3.
الطور الغازي وحالة البلازما

غاز الهيليوم في أنبوب تفريغ على شكل الرمز الكيميائي للعنصر
يكون الهيليوم في في الطور الغازي في أغلب الحالات، وذلك على شكل غاز أحادي الذرة وعديم اللون والرائحة. بسبب كتلته الذرّيّة المنخفضة فإنّ للهيليوم ناقليّة وسعة حراريّة أعلى من أيّ غاز آخر عدا الهيدروجين، كما أن معدل انتشاره في الأجسام الصلبة أعلى بثلاث مرات من الهواء وحوالي 65% من قيمة انتشار الهيدروجين.لدى الهيليوم قرينة انكسار ثابتة مقارنة مع الغازات الأخرى بحيث أنه يستخدم كمادة قياسية لتصحيح الأخطاء في أجهزة قياس قرينة الانكسار للحالة الغازيّة. عند درجات الحرارة العاديّة فإنّ للهيليوم معامل جول-طومسون سالب، ممّا يعني أنه يسخن عندما يسمح له بالتمدّد، وفقط عند درجة حرارة الانعكاس والتي تتراوح بين 32 و 50 كلفن عند ضغط مقداره 1 جوّ، فإنّ الهيليوم يبرد عندما يتمدّد. عندما تخفّض درجة حرارة الهيليوم دون درجة الحرارة هذه فإنّ الهيليوم يمكن أن يسيّل عن طريق التبريد بالتمديد.
إنّ أغلب الهيليوم الكوني يكون في حالة البلازما، والتي لها خواص مختلفة تماماً عن الهيليوم الذرّي. في حالة البلازما لا ترتبط الإلكترونات بالنواة ممّا يؤدي إلى ازدياد الناقليّة الكهربائيّة، حتّى وإن كان الغاز مؤيّناً بشكل جزئي. إنّ الجسيمات المشحونة تتأثّر بالحقول الكهربائية والمغناطيسيّة، وهذا ما يحدث لجسيمات الهيليوم والهيدروجين في الكون في الرياح الشمسيّة عندما يحدث تأثير متبادل مع الغلاف المغناطيسي للأرض ممّا يؤدّي إلى تشكّل تيارات بيركلاند والشفق القطبي.
الطور السائل والميوعة الفائقة

صورة للهيليوم السائل وهو في حالة الميوعة الفائقة تظهر محاولة قطيرات الهيليوم الهروب من الوعاء الذي يحويها.
هناك حالتين مختلفتين للهيليوم في الطور السائل تعرفان بحالة الهيليوم I و حالة الهيليوم II.
حالة الهيليوم I
عندما يكون الهيليوم دون نقطة غليانه والتي تبلغ 4.22 كلفن وفوق نقطة لامدا التي تبلغ 2.1768 كلفن، فإنّ الهيليوم يكون في حالة سائلة عديمة اللون تدعى حالة الهيليوم I. إنّ الهيليوم في حالته السائلة هيليوم I له قرينة انكسار شبيهة بالغازات مقدارها 1.026، كما أن له لزوجة منخفضة جداً وكثافة تتراوح بين 0.145–0.125 غ/مل.

عكس السوائل العادية، فإن الهيليوم II يتسلق على جدران الوعاء الذي يحويه، بظاهرة تعرف باسم طبقة رولن.
حالة الهيليوم II
عندما تنخفض درجة حرارة الهيليوم السائل دون نقطة لامدا فإنه يبدأ بإظهار خواص غير عادية، وتدعى هذه الحالة هيليوم II. عندما يغلي الهيليوم وهو في الحالة II فإنه نتيجة لناقليته الحرارية المرتفعة لا يظهر فقاعات ولكن يتبخر بشكل مباشر من على السطح. هذه الحالة يمكن ملاحظتها في النظير هيليوم-4 كما يظهرها النظير هيليوم-3 ولكن بدرجات حرارة أقل مما هي عليه للهيليوم-4، ولا يعرف الكثير لحد الآن عن خواص الهيليوم-3 في الحالة II
يظهر الهيليوم وهو في الحالة II خواص الميوعة الفائقة، بحيث أن لزوجته منخفضة جداً تقارب الصفر. لتفسير ذلك اقترحت إحدى النظريات وجود نموذج السائلين بالنسبة للهيليوم II، حيث يكون الهيليوم السائل دون نقطة لامدا مؤلفاً من مزيج من سائلين، الأوّل يحوي نسبة من ذرّات الهيليوم في الحالة الأرضيّة وتكون في حالة من الميوعة الفائقة وتتدفّق بدون أن يكون لها أي لزوجة، في حين أن القسم الثاني يحوي نسبة من ذرات الهيليوم في الحالة المثارة، والتي تتصرف كسائل عادي له لزوجة.
من الخواص التي يظهرها الهيليوم وهو في حالة الميوعة الفائقة هي خاصيّة التسلق، حيث يمكن للهيليوم وهو في هذه الحالة أن يتسرّب ويتسلّق جدران الوعاء الذي يحويه حتى يصل إلى منطقة أسخن بحيث يتبخّر. يشكّل الهيليوم فائق الميوعة بذلك طبقة رقيقة (رقاقة) سماكتها حوالي 30 نانومتر وتدعى باسم رقاقة رولن Rollin film، نسبةً إلى مكتشفها بيرنارد رولن. نتيجةً للخواص التسلقيّة هذه للهيليوم فائق الميوعة فإنه من الصعوبة احتواء الهيليوم السائل.
الخواص الكيميائيّة
ينتمي الهيليوم إلى فصيلة الغازات النبيلة، وهو يحوي إلكترونين اثنين في طبقة غلاف التكافؤ الخارجيّة، بحيث أن المدارات الإلكترونية مكتملة 1S2، بالتالي فهو غاز خامل، وهو أقلّ الغازات النبيلة من حيث النشاط الكيميائي بعد النيون، وبالتالي ثاني أقل العناصر الكيميائيّة من حيث النشاط الكيميائي.لا يبدي الهيليوم أيّ نشاط كيميائي تحت كافة الشروط الطبيعيّة.

أيون هيدريد الهيليوم +HHe.
يكون الهيليوم على شكل أحادي الذرة في أغلب حالات المادة، كما أنه أقلّ غاز أحادي الذرة انحلاليّة (ذوبانيّة) في الماء، ولا يسبقه بضعف الانحلاليّة في الماء إلا بعض الغازات مثل رباعي فلورو الميثان CF4 وسداسي فلوريد الكبريت SF6 وثماني فلورو حلقي البوتان C4F8 والتي لها انحلاليّة (معبّراً عنها بالكسر المولي) تعادل 0.3802 x2/10−5 و 0.4394 x2/10−5 و 0.2372 x2/10−5 على الترتيب، مقابل 0.70797 x2/10−5 للهيليوم.
لا توجد مركّبات كيميائيّة للهيليوم في الظروف القياسيّة من الضغط ودرجة الحرارة، ولكن عندما يعرّض الهيليوم إلى ظروف غير طبيعيّة من الضغط أو نتيجة قذف إلكتروني لنواة الهيليوم فإنّه يمكن أن يشكّل مركّبات كيميائيّة غير مستقرّة تعرف باسم الثنائيات المثارة (إكسايمر) وذلك مع عناصر مثل التنغستن واليود والفلور والكبريت والفوسفور، وذلك عندما تخضع للتفريغ المتوهج أو القذف الإلكتروني.
تحت ظروف التفريغ المرتفعة في جهاز مطيافية الكتلة يمكن أن يتشكّل أيون هيدريد الهيليوم ولكنّه غير قابل للعزل. إنّ +HeH في حالته الأرضيّة مستقرّ، ولكنه نشيط كيميائيّاً بشكل كبير جداً، بحيث يعدّ أقوى حمض وفق نظرية برونستد-لوري حيث أنه يمنح البروتون بشكل فوري عند تماسه مع أيّ جزيء أو مركب، وذلك بغضّ النظر عن التركيز. نظريّاً، يمكن أن توجد هناك مركبات أخرى للهيليوم مثل فلوروهيدريد الهيليوم HHeF، وذلك قياساً لمركب فلوروهيدريد الأرغون.أظهرت حسابات الكيمياء النظريّة إمكانيّة وجود مركبات أخرى للهيليوم حاوية على رابطة هيليوم-أكسجين، والتي يمكن أن تكون مستقرّة.
جرى مؤخراً حبس ذرة الهيليوم داخل قفص كربوني، وذلك عند تسخين الفوليرينات إلى درجات حرارة مرتفعة بوجود الهيليوم. يتشكّل حينها ما يعرف باسم الفوليرينات ذات السطح الداخلي endohedral fullerene، والتي تبقى محتوية على الهيليوم محتجزاً داخلها حتّى حين إجراء اشتقاق مركّبات كيميائيّة منها. وفي حال استعمال النظير هيليوم-3 يمكن أن يكشف ذلك باستعمال مطيافية الرنين المغناطيسي النووي للهيليوم. لا تعدّ هذه المركّبات مركّبات للهيليوم بالمعنى الحقيقي للكلمة، إذ لا توجد دلائل على حدوث نوع من الرابطة الكيميائيّة بينها وبين العناصر المحيطة بها، إلا أن هذه المركّبات لها خواص مميّزة عن غيرها، ولها صيغة ستوكيومتريّة خاصّة بها. يرمز لهذه المركّبات بالأسلوب التالي: He@C60.
الاستخدامات

إنّ أكبر استهلاك للهيليوم هو استخدامه في تبريد أجهزة المغناطيس فائقة الموصلية المستخدمة في تقنيّات عدّة كالتصوير بالرنين المغناطيسي على سبيل المثال.
يستخدم الهيليوم في عدة مجالات وتطبيقات بما يتناسب مع خواصه المميّزة، مثل انخفاض نقطة غليانه وكثافته وانحلاليّته المنخفضة، بالإضافة إلى ناقليّته الحراريّة المرتفعة وخواصه الخاملة. بلغ الإنتاج العالمي من الهيليوم عام 2008 حوالي 32 مليون كغ (ما يعادل 193 مليون متر مكعّب)، وكان أكبر استهلاك له (حوالي 22%) في تبريد أجهزة المغناطيس فائق الموصلية المستخدمة في عدة تقنيّات مثل أجهزة التصوير بالرنين المغناطيسي. إنّ مصادم الهدرونات الكبير في سرن CERN يستخدم حوالي 96 طن متري من الهيليوم السائل للحفاظ على درجات حرارة دون 1.9 كلفن.
نتيجة خموله الكيميائي، يستخدم الهيليوم كغاز واقي في إنتاج رقائق السيليكون والجرمانيوم وفي إنتاج التيتانيوم والزركونيوم وفي الاستشراب الغازي. كما يستخدم الهيليوم كغاز واقي في عمليّات اللحام القوسي على المواد التي يؤدّي لحامها عند درجات حرارة مرتفعة إلى إشابتها أو إضعافها بالهواء أو بالنيتروجين. يستخدم الهيليوم عوضاً عن الأرغون للحام المواد التي لها ناقليّة حراريّة مرتفعة مثل الألمنيوم أو النحاس.

جهاز لكشف التسريبات باستخدام غاز الهيليومن ويكبيديا
من إحدى التطبيقات الصناعيّة لغاز الهيليوم استخدامه في كشف التسريب في الأجهزة التي تستخدم تفريغ مرتفع مثل الحاويات المستخدمة في التبريد العميق، وذلك لأن الهيليوم ينتشر في الأجسام الصلبة أسرع بثلاث مرات من الهواء. يوضع الجهاز المراد كشف التسريب فيه في حجرة تخلّى من الهواء وتملأ بالهيليوم، ويقاس الهيليوم الذي ينفد من مكان التسريب باستخدام أجهزة مخصصة لذلك. بالمقابل يمكن ملء الجهاز المراد كشف التسريب فيه بالهيليوم ويكشف عن مكان التسريب بجهاز يمرر يدويّاً على الجهاز بالكامل.

يستخدم الهيليوم في ملء المناطيد
لأنّ وزنه أخف من الهواء، يستخدم الهيليوم في ملء السفن الهوائية والمناطيد لتتمكّن من الطيران. على الرغم من أنّ الهيدروجين أخفّ من الهيليوم، لكنّه قابل للاشتعال، في حين أنّ الهيليوم لا يشتعل.
يدخل الهيليوم في تركيب غازات التنفس في أجهزة الغوص العميق، مثل تريمكس وهيليوكس، وذلك للتخفيف من الآثار التخديرية لغازات التنفس عند الضغوط المرتفعة. وجد أنّ الغوص إلى أعماق دون 150 متر باستخدام أجهزة تنفس أكسجين-هيليوم تؤدّي إلى حدوث رعاش واضطراب في الوظائف الحسّيّة الحركيّة، ممّا يعدّ مؤشّراً على حدوث أعراض متلازمة الضغط العالي العصبي، أو ما يعرف باسم رعاش الهيليوم. هذا الأثر يمكن أن يعود إلى حدّ ما نتيجة إضافة كمّيّات من غاز له خواص تخديريّة في الغطس مثل الهيدروجين أو النيتروجين إلى مزيج أكسجين-هيليوم. في أعماق كهذه، وجد أن الكثافة المنخفضة للهيليوم لها دور في تخفيف المجهود المبذول للتنفس.
استخدم ليزر هيليوم-نيون، وهو نوع من ليزر الغاز له طاقة منخفضة، وذلك من أجل إنتاج حزمة حمراء اللون، وذلك في عدّة تطبيقات مثل قارئ الشفرة الخيطية ومؤشر الليزر، وذلك قبل أن يستبدل بليزر الصمام الثنائي.
يستخدم الهيليوم كوسط لتبادل الحرارة في بعض المفاعلات النوويّة المبرّدة بالغاز وذلك بسبب خموله الكيميائي وبسبب ناقليّته الحراريّة العاليّة، وعدم تأثره بالنيوترونات، ولعدم تشكيله نظائر مشعّة تحت شروط عمل المفاعل.
عند مزج الهيليوم مع غاز أثقل مثل الزينون فإنّه يستخدم في المحركات الصوتيّة الحراريّة المستخدمة في التبريد، وذلك نتيجةً لارتفاع نسبة السعة الحرارية الناتجة ولانخفاض عدد برانتل. إنّ خمول غاز الهيليوم له آثار إيجابيّة على البيئة مقابل أنظمة التبريد التقليديّة التي تؤدي إلى نضوب الأوزون والاحترار العالمي.
إنّ استعمال الهيليوم يقلّل من الآثار المشوّشة في بعض المقاريب، والتي تحصل نتيجة تفاوت درجة الحرارة في الفراغ بين العدسات، وذلك بسبب الانخفاض الكبير لقيمة قرينة الانكسار بالنسبة للهيليوم.تعد هذه طريقة عملية بالنسبة للمقاريب الشمسية التي تكون بحاجة إلى استخدام أنبوب تفريغ والذي غالباً ما يكون ثقيل الوزن.
الاستنشاق وإجراءات الأمان
الآثار
إنّ الهيليوم في الشروط العادية عبارة عن غاز غير سام وليس له تأثير حيوي على جسم الإنسان عند التعرّض له. ولكن عندما يستنشق الهيليوم عن طريق الفم فإنّ له تأثير على الحبال الصوتيّة بحيث يظهر الصوت كأنه مُسرّع. سبب هذا الأثر أنّ سرعة الصوت في الهيليوم أسرع منها بثلاث مرات من الهواء. بما أنّ التردّد الأساسي لتجويف مملوء بغاز متناسب مع سرعة الصوت في هذا الغاز، لذلك فإنّه عندما يستنشق الهيليوم فإنّ هنالك ازدياد في رنين المجرى الصوتي. إنّ تردّدات الرنين العالية تسبّب اختلاف في طابع الصوت بحيث يظهر متسارعاً (مزقزق، كما يعرف أحياناً باسم صوت ميكي ماوس).إنّ التأثير المعاكس بتخفيض تردّد الرنين يمكن الحصول عليه باستنشاق غاز كثيف مثل سداسي فلوريد الكبريت أو الزينون.
المخاطر
إنّ المبالغة في استنشاق الهيليوم لتحقيق أثره على الحبال الصوتيّة يمكن أن يكون خطراً، حيث يؤدّي إلى الاختناق لأنّه يحلّ محلّ الأكسجين اللازم لعمليّة التنفّس. سجّلت حالات وفاة ناتجة عن المبالغة في استنشاق الهيليوم، من بينهم أطفال وبالغين.
إنّ استنشاق الهيليوم مباشرةً من الأسطوانات المضغوطة خطر جداً، حيث يمكن أن يؤدّي إلى حدوث رضح ضغطي نتيجة معدّل السرعة العالي للهيليوم المتدفّق، والذي يمكن أن ينجم عنه تمزّق مميت لأنسجة الرئتين.
ينبغي اتّباع إجراءات الأمان اللازمة عند التعامل مع الهيليوم السائل، لأنّ درجة الحرارة المنخفضة يمكن أن تؤدّي إلى عضة برد. كما ينبغي الانتباه إلى ضرورة ضبط الضغط لأنّ نسبة تمدد السائل-إلى-الغاز المرتفعة يمكن أن تؤدّي إلى حدوث انفجارات إن لم يكن هناك صمّامات ضغط متوفّرة.
↑
He
↓
Ne
2He
المظهر
غاز عديم اللون ذو وميض أرجواني في حالة التفريغ الكهربائي


الخطوط الطيفية للهيليوم
الخواص العامة
غاز عديم اللون ذو وميض أرجواني في حالة التفريغ الكهربائي


الخطوط الطيفية للهيليوم
الخواص العامة
تصنيف العنصر غاز نبيل
المجموعة، الدورة، المستوى الفرعي 18، 1، s
الكتلة الذرية 4.0026 غ·مول−1
توزيع إلكتروني 1s2
توزيع الإلكترونات لكل غلاف تكافؤ 2 (صورة)
الخواص الفيزيائية
الطور غاز
الكثافة (0 °س، 101.325 كيلوباسكال)
0.1786 غ/ل
كثافة السائل عند نقطة الانصهار 0.145 غ·سم−3
نقطة الانصهار (عند 2.5 ميغاباسكال) 0.95 ك، −272.20 °س
نقطة الغليان 4.22 ك، −268.93 °س
النقطة الحرجة 5.19 ك، 0.227 ميغاباسكال
حرارة الانصهار 0.0138 كيلوجول·مول−1
حرارة التبخر 0.0829 كيلوجول·مول−1
السعة الحرارية (عند 25 °س) 20.786 جول·مول−1·كلفن−1
ضغط البخار
ض (باسكال) 1 10 100 1 كيلو 10 كيلو 100 كيلو
عند د.ح. (كلفن) 1.23 1.67 2.48 4.21
الخواص الذرية
الكهرسلبية لا بيانات (مقياس باولنغ)
طاقات التأين الأول: 2372.3 كيلوجول·مول−1
الثاني: 5250.5 كيلوجول·مول−1
نصف قطر تساهمي 28 بيكومتر
نصف قطر فان دير فالس 140 بيكومتر
خواص أخرى
البنية البلورية نظام بلوري سداسي مرصوص
المغناطيسية مغناطيسية معاكسة
الناقلية الحرارية 0.1513 واط·متر−1·كلفن−1 (300 كلفن)
سرعة الصوت 972 متر/ثانية
رقم الكاس 7440-59-7
النظائر الأكثر ثباتاً
المقالة الرئيسية: نظائر الهيليوم
النظائر الوفرة الطبيعية عمر النصف نمط الاضمحلال طاقة الاضمحلال MeV ناتج الاضمحلال
3He 0.000137%* 3He هو نظير مستقر وله 1 نيوترون
4He 99.999863%* 4He هو نظير مستقر وله 2 نيوترون
*القيم حسب الوفرة في الغلاف الجوي، لكنها يمكن أن تكون غير ذلك خارجه
الهيليوم هو عنصر كيميائي له الرمز He وله العدد الذري 2. يقع الهيليوم في الجدول الدوري ضمن عناصر الدورة الأولى وعلى رأس عناصر المجموعة الثامنة عشر. في الظروف القياسيّة من الضغط ودرجة الحرارة فإنّ الهيليوم عبارة عن غاز عديم اللون والرائحة، غير سام وليس له مذاق. ينتمي الهيليوم إلى الغازات النبيلة لذلك فهو غاز خامل أحادي الذرة، وبسبب خموله الكيميائي لا توجد جزيئات له، فهو يوجد دائماً في صورته الذريّة. للهيليوم أقلّ درجة غليان وانصهار مقارنةً ببقيّة العناصر الكيميائيّة، وهو يوجد أغلب الأحيان في الحالة الغازيّة باستثناء ظروف خاصة جداً.
يعدّ الهيليوم ثاني أخفّ العناصر في الكون بعد الهيدروجين، كما أنه ثاني أكثر العناصر وفرةً في الكون، حيث يشكّل 24% من الكون بالنسبة لكتلة العناصر. بالنسبة لوفرته على الأرض فإن الهيليوم نادر الوجود طبيعيّاً، حيث يشكّل فقط 5.2 جزء من المليون بالنسبة للغلاف الجوي. للهيليوم عدّة نظائر لكنّ أكثر من 99% من الهيليوم على الأرض هو هيليوم-4، والذي تتألّف نواته من بروتونين ونيوترونين اثنين.
يوجد غاز الهيليوم في بعض حقول الغاز الطبيعي بنسبة تصل إلى 7% حجماً، حيث يستخرج من هناك بواسطة التقطير التجزيئي. تجدر الإشارة إلى أن مصادر الهيليوم قابلة للنفاد، حيث أنّه العنصر الوحيد الذي لديه سرعة إفلات، أي أنه عندما يطلق في الغلاف الجوي فإنه يتسرّب إلى الفضاء الخارجي.
يستخدم الهيليوم في تقنيّات التبريد العميق، وخاصة لتبريد أجهزة المغناطيس فائق الموصليّة المستخدمة في تقنيّات التصوير بالرنين المغناطيسي. كما يستفاد من الخواص الخاملة لغاز الهيليوم في استعماله كغاز واقي في اللحام القوسي وفي عمليات تصنيع رقائق السيليكون.
التاريخ
الاكتشاف وأصل التسمية
الاكتشاف وأصل التسمية

بيير جانسين
يعد الهيليوم العنصر الوحيد الذي اكتشف في الكون وذلك على الشمس قبل أن يكتشف على الأرض. حدث ذلك عندما لاحظ الفلكي بيير جانسين وجود خط أصفر لامع في طيف الإصدار للغلاف اللوني للشمس أثناء حادثة كسوف كلّي للشمس في الهند عام 1868. في ذات العام لاحظ الفلكي جوزيف نورمان لوكير نفس الخط الأصفر من الطيف الضوئي للشمس، وأسماه خط فراونهوفر D3، لأن له طول موجة مقداره 587.49 نانومتر وهو قريب من خطوط D1 و D2 للصوديوم. بعد ذلك، استنتج لوكير أن الخط الطيفي هذا سببه عنصر موجود في الشمس وغير موجود على الأرض، فأطلق عليه سويّة مع إدوارد فرانكلاند الاسم الإغريقي للشمس ἥλιος هيليوس.
في عام 1895، استطاع العالم البريطاني وليام رامزي أن يعزل الهيليوم على الأرض، عندما قام بمعالجة معدن الكليفيت (وهو معدن مشابه لليورانينيت مع وجود حوالي 10% من العناصر الأرضية النادرة) وذلك بأحماض معدنيّة. توقع رامزي وجود الأرغون، ولكنه بعدما قام بفصل النيتروجين والأكسجين من الغازات المتحرّرة من أثر حمض الكبريتيك، لاحظ وجود خط أصفر مميّز في طيف إصدار المادّة المستخرجة، والذي يشبه خط D3 في طيف الشمس، وشخّصت هذه العيّنات على أنّها هيليوم من قبل لوكير والفيزيائي البريطاني وليام كروكس.في تجربة منفصلة قام العالم بير تيودور كليفه مع مساعده أبراهام لانغليت بجمع عينات من غاز الهيليوم من معدن الكليفيت في جامعة أوبسالا في السويد وذلك من أجل تحديد كتلته الذريّة.

وليام رامزي
اكتشافات علميّة
في عام 1907، أظهر العالم إرنست رذرفورد مع توماس رويدز أن جسيم ألفا هو نواة الهيليوم، وذلك من خلال قيامه بالسماح لجسيمات ألفا أن تخترق جدار زجاجي رقيق لأنبوب التفريغ، مما أدّى إلى حدوث تفريغ للشحنة والذي سمح بدراسة طيف الغاز في الداخل.
سُيّل الهيليوم لأول مرّة على يد الفيزيائي هايك كامرلينغ أونس عام 1908، وذلك بتبريد الغاز لأقل من درجة كلفن واحدة حاول أونس الحصول على الحالة الصلبة من الهيليوم بتخفيض درجة الحرارة، لكنه لم يتمكّن من ذلك، لأنه لا توجد للهيليوم نقطة ثلاثية يكون عندها توازن بين الحالات الثلاثة للمادة. بالرغم من ذلك، تمكّن تلميذ أونس الفيزيائي فيليم هندريك كيسوم من تصليب 1 سم3 من الهيليوم بتطبيق ضغط إضافي عند درجات حرارة منخفضة وذلك عام 1926.
في عام 1938، اكتشف الفيزيائي بيوتر كابيتسا أن النظير هيليوم-4 عديم اللزوجة تقريباً في درجات قريبة من الصفر المطلق، وهي الظاهرة التي تعرف اليوم بالميوعة الفائقة. في عام 1972، لوحظت نفس الظاهرة لدى النظير هيليوم-3 وذلك من قبل الفيزيائيّين دوغلاس أوشيروف وديفد لي وروبرت ريتشاردسون، وحازوا بذلك جائزة نوبل في الفيزياء عام 1996.
الاستخراج والاستخدام
اكتشف وجود غاز الهيليوم مع الغاز الطبيعي في الأرض بكميات كافية للإنتاج عام 1903 أثناء التنقيب عن النفط في ديكستر في ولاية كانساس الأمريكية، حيث جمعت كمية من غاز غير قابل للاشتعال. بإجراء عملية تحليل للعيّنة في جامعة كانساس وجد أن الغاز يتألّف من 72% نيتروجين و 15% ميثان و1% هيدروجين و12% من غاز لم يتعرّف عليه حينئذ. بإجراء عملية بحث أعمق وجد هاميلتون كادي و ديفد ماكفارلاند من جامعة كانساس أن 1.84% من العيّنة عبارة عن غاز الهيليوم. أظهرت هذه الأبحاث أنّه على الرغم من ندرة وجود الهيليوم على الأرض فإنّه يتركّز تحت السهول الكبرى بكميّات كبيرة كافية كناتج ثانوي في عملية استخراج الغاز الطبيعي.
هذه الوقائع جعلت من الولايات المتحدة أكبر مزوّد للهيليوم، وجرى الاستفادة من ذلك في الحرب العالميّة الأولى في تعبئة المناطيد الحاجزة بغاز أخف من الهواء مثل الهيدروجين، لكنّه غير قابل للاشتعال. بناءً على ذلك جرى استعمال الهيليوم في تجهيز المناطيد العسكريّة. أوّل منطاد استعمل لهذا الغرض سمّي U.S. Navy's C-7 وأقلعت أول رحلة تجريبيّة له من هامبتون رودز في ولاية فيرجينيا إلى قاعدة بولينغ فيلد العسكريّة في واشنطن في الأوّل من ديسمبر عام 1921. استمرّ استخدام الهيليوم في المجال العسكري حتى الحرب العالميّة الثانيّة في عمليّات اللحام القوسي من أجل التجهيزات العسكريّة واستخدم كغاز لكشف التسريبات في عملية الانتشار الغازي أثناء تخصيب اليورانيوم لتصنيع القنبلة الذريّة في مشروع مانهاتن.
الوفرة الطبيعيّة

يشكّل الهيليوم حوالي 19% من الغلاف الغازي الخارجي لكوكب نبتون.
على الرغم من ندرته على سطح الأرض فإن الهيليوم يعدّ ثاني أكثر العناصر بعد الهيدروجين وفرة في الكون مشكّلاً 23% من كتلته الباريونيّة. تشكّلت هذه الكميّة الهائلة من الهيليوم بعد فترة قليلة من الانفجار العظيم. يتشكّل الهيليوم في النجوم نتيجة الاندماج النووي للهيدروجين في تفاعل بروتون-بروتون المتسلسل ودورة كربون-نيتروجين-أكسجين (دورة CNO)، والتي تعدّ جزءاً من تفاعلات الانصهار النجمي.
إنّ تركيز الهيليوم في الغلاف الجوي للأرض يعادل 5.2 جزء في المليون، وهو يتركّز في طبقات الجو العليا من غلاف الأرض الجوي.هذا التركيز الضئيل ثابت نسبياً في الغلاف الجوّي رغم الإنتاج المستمرّ للهيليوم، ويعود ذلك إلى انفلات الغاز من الغلاف الجوّي للأرض إلى الفضاء الخارجي وذلك بعدّة آليّات مقترحة.
يدخل الهيليوم في تركيب الغلاف الغازي للعديد من الكواكب بنسب تظهر في الجدول التالي:
نبتون 19 % ± 3.2 %
أورانوس 15.2 % ± 3.3 %
المشتري 10.2 %
زحل 3.25 %
الزهرة 12 جزء في المليون
الأرض 5.2 جزء في المليون
إنّ معظم الهيليوم الموجود على الأرض هو نتيجة الاضمحلال الإشعاعي للعناصر الثقيلة نتيجة إطلاق جسيمات ألفا 2+He، والتي تتجمّع إلكتروناتها لتشكّل الهيليوم عندما تصطدم بالغلاف الصخري. لذلك يوجد الهيليوم بكميّات كبيرة نسبياً في تركيب عدّة معادن لليورانيوم والثوريوم بسبب إطلاقها لجسيمات ألفا أثناء اضمحلالها الإشعاعي مثل اليورانينيت (خاصةً الكليفيت، وهو أحد مشتقّات اليورانيتيت) والكارنوتيت والمونازيت. على هذا الأساس ينتج سنوياً حوالي 3000 طن متري من الهيليوم عبر غلاف الأرض الصخري. إنّ تركيز الهيليوم في القشرة الأرضية هو 8 جزء في البليون، وفي مياه البحار فقط حوالي 4 جزء في الترليون. توجد كمّيّات قليلة من الهيليوم في الينابيع المعدنيّة والغازات البركانيّة والأحجار النيزكيّة.
إنّ المصدر الطبيعي الأكبر للهيليوم هو وجوده في بعض آبار الغاز الطبيعي نتيجة احتباسه تحت الطبقات الصخريّة للأرض. تختلف التراكيز حسب المواقع من عدّة أجزاء في المليون إلى حوالي 7% حجماً من كميّة الغاز المستخرجة كما في حقل الغاز في مقاطعة سان خوان في نيومكسيكو.
الإنتاج
ينتج غاز الهيليوم بشكلٍ صناعي بعملية التقطير التجزيئي للغاز الطبيعي، والذي يمكن أن يوجد بنسبة تصل حتى 7% حجماً.بما أن للهيليوم نقطة غليان أقلّ من أيّ عنصر كيميائي آخر، فإنّ تطبيق درجات حرارة منخفضة عند ضغوط مرتفعة يؤدي إلى تسييل الغازات الأخرى مثل النيتروجين والميثان. بعد ذلك تجري عملية تنقية لغاز الهيليوم بالتعريض المتتالي لدرجات حرارة منخفضة بحيث يضمن عدم بقاء أي أثر لغازات أخرى. كخطوة نهائية للتنقية يستعمل الفحم المنشّط مما يعطي نقاوة تصل إلى 99.995% وتدعى بنقاوة من الدرجة A إنّ الشائبة الرئيسيّة في الهيليوم من الدرجة A هو غاز النيون. في مرحلة الإنتاج النهائيّة يسيّل الهيليوم من خلال عمليات تبريد عميقة بحيث يكون على شكل هيليوم سائل، ممّا يسهّل من عملية النقل، حيث أن حاوية نقل الهيليوم كسائل تسع أكثر بخمسة أضعاف الحجم الذي تنقله حاويات الهيليوم كغاز.
تعدّ الولايات المتّحدة الأمريكيّة أكبر منتج لغاز الهيليوم حيث أتت مرحلة كانت تنتج فيها أكثر من 90% من الاحتياج العالمي لهذا الغاز، وما تبقى تنتجه محطّات توجد في كندا وبولونيا وروسيا، بالإضافة إلى عدّة دول أخرى. إنّ معظم الهيليوم المستخرج في الولايات المتّحدة هو من حقل هيوغوتون للغاز في ولاية كانساس، بالإضافة إلى حقول أخرى في أوكلاهوما وفي حقل بانهاندل في تكساس. للهيليوم استهلاك كبير في الولايات المتّحدة، ومنذ أوائل القرن العشرين فإن للولايات المتّحدة مخزون وطني من هذه الخامة. قُدّر استهلاك الولايات المتحدة من غاز الهيليوم عام 2000 بحوالي 15 مليون كغ سنوياً. في منتصف التسعينات افتتحت محطّة جديدة لتوليد الهيليوم في مدينة أرزيو الجزائريّة لها القدرة على إنتاج 17 مليون متر مكعّب من غاز الهيليوم مما يغطّي الطلب الأوروبي من الهيليوم في السوق العالمي. وبين عامي 2004 و 2006 افتتحت محطّتان جديدتان لإنتاج الهيليوم وذلك في رأس لفان في قطر وفي مدينة سكيكدة في الجزائر. مع افتتاح محطّة سكيكدة أصبحت الجزائر ثاني منتج للهيليوم في السوق العالمي. حسب إحصاءات أجريت عام 2008، فقد استخرج حوالي 169 مليون متر مكعّب من الهيليوم من الغاز الطبيعي وذلك بنسبة 78% من الولايات المتحدة الأمريكية و10% من الجزائر ومعظم ما تبقّى تنتجه دول متعدّدة على رأسها روسيا وبولونيا وقطر.
إنّ ازدياد الطلب العالمي على الهيليوم ومحدوديّة الإنتاج أدّيا إلى ارتفاع سعر إنتاج الهيليوم في العالم، بحيث أنه بين عامي 2002 و 2007 ازداد سعر الهيليوم بمقدار الضعف. نتيجة محدوديّة موارد الهيليوم تجري حالياً استخدام تقنيّات يطبق فيها انتشار للغاز الطبيعي الخام عبر أغشية نصف نفوذة من أجل استرجاع وتنقية الهيليوم.
النظائر
لتفاصيل أكثر عن هذا الموضوع، انظر نظائر الهيليوم.
هنالك تسعة نظائر معروفة للهيليوم، اثنان منها فقط عبارة عن نظائر مستقرّة وهي هيليوم-4 4He وهيليوم-3 3He. يعدّ النظير هيليوم-4 هو النظير الطبيعي الأكثر وفرةً حيث أن 99.99986% من عنصر الهيليوم في الطبيعة هو هيليوم-4، وما تبقّى فهو هيليوم-3. إحصائيّاً هنالك ذرّة هيليوم-3 واحدة مقابل مليون ذرّة هيليوم-4. ينتج النظير هيليوم-4 في الأرض كناتح لعمليّة اضمحلال ألفا للعناصر المشعّة الأثقل حيث تنتج جسيمات ألفا، والتي هي عبارة عن نوى هيليوم مشحونة. تتميّز نواة النظير هيليوم-4 بثباتيّة عاليّة لأن نويّاتها مرتّبة بشكل كامل في غلافها النووي. إنّ الكميّات النادرة للنظير هيليوم-3 موجودة في الطبيعة منذ نشأة الأرض، بالإضافة إلى هبوط كمّيّات مصدرها من الكون، والتي كانت محتجزة ضمن الغبار الكوني، كما تنتج كمّيّات قليلة من الهيليوم-3 من اضمحلال بيتا للتريتيوم.
خواص النظائر 3He 4He
الطاقة الساكنة (ميغا إلكترون فولت) 2809 3728
الكثافة كغ/م3 0.134 0.178
درجة الحرارة الحرجة (كلفن) 3.32 5.20
نقطة لامدا (كلفن) 0.0025 2.1768
الضغط عند الانصهار (ميغا إلكترون فولت) عند 0 كلفن 3.439 2.536
نقطة الانصهار (كلفن) 3.19 4.21
إنّ تفاوت نسبة النظيرين هيليوم-3 وهيليوم-4 في الصخور يستخدم من أجل تحديد عمر الصخور ومعرفة أصل منشأها في الغلاف الصخري للأرض. إنّ نسبة النظير هيليوم-3 3He إلى هيليوم-4 4He في الكون أعلى منها على الأرض بحوالي 100 مرّة وذلك في الوسط بين النجمي.كما أنّ وفرته في النجوم كبيرة نسبياً نتيجة الاندماج النووي. إنّ المواد الكونيّة مثل الحطام الصخري للأقمار والأحجار النيزكية تحوي أيضاً نسب من هيليوم-3، والتي اصطحبتها الرياح الشمسيّة، كما أنّ سطح القمر يحوي الهيليوم-3 بتراكيز أعلى منها على سطح الأرض.
إنّ مزيج من كمّيّتين متساويتين من 3He و 4He السائل تحت 0.8 كلفن سينفصل إلى طبقتين غير مزوجتين وذلك نتيجة لتباين الإحصاءات الكموميّة لهما، حيث أن 4He عبارة عن بوزون، في حين أنّ 3He فرميون. يستفاد من خاصة عدم امتزاج هذين النظيرين في ثلاجة التمديد، حيث يمكن استخدام هذا التطبيق للحصول على درجات حرارة بحدود بضعة ميلي كلفن.
الخواص الفيزيائيّة
الهيليوم في ميكانيكا الكم

تمثيل لذرّة الهيليوم تظهر فيه نواة ذرّة الهيليوم في المنتصف وحولها السحابة الإلكترونيّة.
من منظور ميكانيكا الكم فإنّ الهيليوم ثاني أبسط ذرّة يمكن إجراء نموذج لها بعد ذرّة الهيدروجين. يتألّف الهيليوم من نواة تتألّف من بروتونين ونيوترونين اثنين، يحيط بهما إلكترونين اثنين في مداراتها الذريّة. حسب ميكانيك نيوتن التقليدي فإنه من غير الممكن تقديم حل رياضي تحليلي لنظام يتألّف من أكثر من جسيمين اثنين، وذلك حسب معضلة الأجسام الثلاث. بناءً على ذلك، تستخدم وسائل رياضيّة عدديّة عن طريق الكيمياء الحاسوبية لوضع نموذج ميكانيكي كمّي لارتباط إلكترونات الهيليوم بالنواة. رغم بساطة نموذج النواة ظاهرياً فإن معادلات معقّدة ضروريّة لوضع محاكاة لنموذج الذرّة الحقيقي.
أطوار الهيليوم
إنّ الهيليوم في الأحوال العادية عبارة عن غاز، وعند درجات حرارة منخفضة عند نقطة انصهاره يصبح بالطور السائل. إلا أنّ الهيليوم هو العنصر الوحيد الذي لا يمكن الحصول على الطور الصلب منه تحت ظروف الضغط العادي. يجب رفع الضغط إلى قيم تصل نحو 2.5 ميغا باسكال عند درجات حرارة منخفضة جداً (أقل من 1.5 كلفن أي ما يعادل −272 °س).
يشكّل الهيليوم الصلب بلّورات ولكن لا يمكن فصل الهيليوم الصلب عن السائل بصريّاً، لأن قرينة الانكسار لهما متقاربة جداً. للهيليوم الصلب قابلية انضغاط عالية، بحيث أنه من الممكن مخبريّاً إنقاص حجمه بأكثر من 30%. تبلغ كثافة الهيليوم الصلب 0.214 ± 0.006 غ/سم3 عند 1.15 كلفن و 66 جو، والكثافة المتوقعة عند 0 كلفن وضغط قدره 25 بار هي 0.187 ± 0.009 غ/سم3.
الطور الغازي وحالة البلازما

غاز الهيليوم في أنبوب تفريغ على شكل الرمز الكيميائي للعنصر
يكون الهيليوم في في الطور الغازي في أغلب الحالات، وذلك على شكل غاز أحادي الذرة وعديم اللون والرائحة. بسبب كتلته الذرّيّة المنخفضة فإنّ للهيليوم ناقليّة وسعة حراريّة أعلى من أيّ غاز آخر عدا الهيدروجين، كما أن معدل انتشاره في الأجسام الصلبة أعلى بثلاث مرات من الهواء وحوالي 65% من قيمة انتشار الهيدروجين.لدى الهيليوم قرينة انكسار ثابتة مقارنة مع الغازات الأخرى بحيث أنه يستخدم كمادة قياسية لتصحيح الأخطاء في أجهزة قياس قرينة الانكسار للحالة الغازيّة. عند درجات الحرارة العاديّة فإنّ للهيليوم معامل جول-طومسون سالب، ممّا يعني أنه يسخن عندما يسمح له بالتمدّد، وفقط عند درجة حرارة الانعكاس والتي تتراوح بين 32 و 50 كلفن عند ضغط مقداره 1 جوّ، فإنّ الهيليوم يبرد عندما يتمدّد. عندما تخفّض درجة حرارة الهيليوم دون درجة الحرارة هذه فإنّ الهيليوم يمكن أن يسيّل عن طريق التبريد بالتمديد.
إنّ أغلب الهيليوم الكوني يكون في حالة البلازما، والتي لها خواص مختلفة تماماً عن الهيليوم الذرّي. في حالة البلازما لا ترتبط الإلكترونات بالنواة ممّا يؤدي إلى ازدياد الناقليّة الكهربائيّة، حتّى وإن كان الغاز مؤيّناً بشكل جزئي. إنّ الجسيمات المشحونة تتأثّر بالحقول الكهربائية والمغناطيسيّة، وهذا ما يحدث لجسيمات الهيليوم والهيدروجين في الكون في الرياح الشمسيّة عندما يحدث تأثير متبادل مع الغلاف المغناطيسي للأرض ممّا يؤدّي إلى تشكّل تيارات بيركلاند والشفق القطبي.
الطور السائل والميوعة الفائقة

صورة للهيليوم السائل وهو في حالة الميوعة الفائقة تظهر محاولة قطيرات الهيليوم الهروب من الوعاء الذي يحويها.
هناك حالتين مختلفتين للهيليوم في الطور السائل تعرفان بحالة الهيليوم I و حالة الهيليوم II.
حالة الهيليوم I
عندما يكون الهيليوم دون نقطة غليانه والتي تبلغ 4.22 كلفن وفوق نقطة لامدا التي تبلغ 2.1768 كلفن، فإنّ الهيليوم يكون في حالة سائلة عديمة اللون تدعى حالة الهيليوم I. إنّ الهيليوم في حالته السائلة هيليوم I له قرينة انكسار شبيهة بالغازات مقدارها 1.026، كما أن له لزوجة منخفضة جداً وكثافة تتراوح بين 0.145–0.125 غ/مل.

عكس السوائل العادية، فإن الهيليوم II يتسلق على جدران الوعاء الذي يحويه، بظاهرة تعرف باسم طبقة رولن.
حالة الهيليوم II
عندما تنخفض درجة حرارة الهيليوم السائل دون نقطة لامدا فإنه يبدأ بإظهار خواص غير عادية، وتدعى هذه الحالة هيليوم II. عندما يغلي الهيليوم وهو في الحالة II فإنه نتيجة لناقليته الحرارية المرتفعة لا يظهر فقاعات ولكن يتبخر بشكل مباشر من على السطح. هذه الحالة يمكن ملاحظتها في النظير هيليوم-4 كما يظهرها النظير هيليوم-3 ولكن بدرجات حرارة أقل مما هي عليه للهيليوم-4، ولا يعرف الكثير لحد الآن عن خواص الهيليوم-3 في الحالة II
يظهر الهيليوم وهو في الحالة II خواص الميوعة الفائقة، بحيث أن لزوجته منخفضة جداً تقارب الصفر. لتفسير ذلك اقترحت إحدى النظريات وجود نموذج السائلين بالنسبة للهيليوم II، حيث يكون الهيليوم السائل دون نقطة لامدا مؤلفاً من مزيج من سائلين، الأوّل يحوي نسبة من ذرّات الهيليوم في الحالة الأرضيّة وتكون في حالة من الميوعة الفائقة وتتدفّق بدون أن يكون لها أي لزوجة، في حين أن القسم الثاني يحوي نسبة من ذرات الهيليوم في الحالة المثارة، والتي تتصرف كسائل عادي له لزوجة.
من الخواص التي يظهرها الهيليوم وهو في حالة الميوعة الفائقة هي خاصيّة التسلق، حيث يمكن للهيليوم وهو في هذه الحالة أن يتسرّب ويتسلّق جدران الوعاء الذي يحويه حتى يصل إلى منطقة أسخن بحيث يتبخّر. يشكّل الهيليوم فائق الميوعة بذلك طبقة رقيقة (رقاقة) سماكتها حوالي 30 نانومتر وتدعى باسم رقاقة رولن Rollin film، نسبةً إلى مكتشفها بيرنارد رولن. نتيجةً للخواص التسلقيّة هذه للهيليوم فائق الميوعة فإنه من الصعوبة احتواء الهيليوم السائل.
الخواص الكيميائيّة
ينتمي الهيليوم إلى فصيلة الغازات النبيلة، وهو يحوي إلكترونين اثنين في طبقة غلاف التكافؤ الخارجيّة، بحيث أن المدارات الإلكترونية مكتملة 1S2، بالتالي فهو غاز خامل، وهو أقلّ الغازات النبيلة من حيث النشاط الكيميائي بعد النيون، وبالتالي ثاني أقل العناصر الكيميائيّة من حيث النشاط الكيميائي.لا يبدي الهيليوم أيّ نشاط كيميائي تحت كافة الشروط الطبيعيّة.

أيون هيدريد الهيليوم +HHe.
يكون الهيليوم على شكل أحادي الذرة في أغلب حالات المادة، كما أنه أقلّ غاز أحادي الذرة انحلاليّة (ذوبانيّة) في الماء، ولا يسبقه بضعف الانحلاليّة في الماء إلا بعض الغازات مثل رباعي فلورو الميثان CF4 وسداسي فلوريد الكبريت SF6 وثماني فلورو حلقي البوتان C4F8 والتي لها انحلاليّة (معبّراً عنها بالكسر المولي) تعادل 0.3802 x2/10−5 و 0.4394 x2/10−5 و 0.2372 x2/10−5 على الترتيب، مقابل 0.70797 x2/10−5 للهيليوم.
المركّبات الكيميائيّة
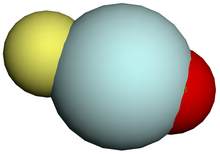
البنية المحتملة لأنيون فلوروهيليات
-OHeF.

البنية المحتملة لأنيون فلوروهيليات
-OHeF.
لا توجد مركّبات كيميائيّة للهيليوم في الظروف القياسيّة من الضغط ودرجة الحرارة، ولكن عندما يعرّض الهيليوم إلى ظروف غير طبيعيّة من الضغط أو نتيجة قذف إلكتروني لنواة الهيليوم فإنّه يمكن أن يشكّل مركّبات كيميائيّة غير مستقرّة تعرف باسم الثنائيات المثارة (إكسايمر) وذلك مع عناصر مثل التنغستن واليود والفلور والكبريت والفوسفور، وذلك عندما تخضع للتفريغ المتوهج أو القذف الإلكتروني.
تحت ظروف التفريغ المرتفعة في جهاز مطيافية الكتلة يمكن أن يتشكّل أيون هيدريد الهيليوم ولكنّه غير قابل للعزل. إنّ +HeH في حالته الأرضيّة مستقرّ، ولكنه نشيط كيميائيّاً بشكل كبير جداً، بحيث يعدّ أقوى حمض وفق نظرية برونستد-لوري حيث أنه يمنح البروتون بشكل فوري عند تماسه مع أيّ جزيء أو مركب، وذلك بغضّ النظر عن التركيز. نظريّاً، يمكن أن توجد هناك مركبات أخرى للهيليوم مثل فلوروهيدريد الهيليوم HHeF، وذلك قياساً لمركب فلوروهيدريد الأرغون.أظهرت حسابات الكيمياء النظريّة إمكانيّة وجود مركبات أخرى للهيليوم حاوية على رابطة هيليوم-أكسجين، والتي يمكن أن تكون مستقرّة.
جرى مؤخراً حبس ذرة الهيليوم داخل قفص كربوني، وذلك عند تسخين الفوليرينات إلى درجات حرارة مرتفعة بوجود الهيليوم. يتشكّل حينها ما يعرف باسم الفوليرينات ذات السطح الداخلي endohedral fullerene، والتي تبقى محتوية على الهيليوم محتجزاً داخلها حتّى حين إجراء اشتقاق مركّبات كيميائيّة منها. وفي حال استعمال النظير هيليوم-3 يمكن أن يكشف ذلك باستعمال مطيافية الرنين المغناطيسي النووي للهيليوم. لا تعدّ هذه المركّبات مركّبات للهيليوم بالمعنى الحقيقي للكلمة، إذ لا توجد دلائل على حدوث نوع من الرابطة الكيميائيّة بينها وبين العناصر المحيطة بها، إلا أن هذه المركّبات لها خواص مميّزة عن غيرها، ولها صيغة ستوكيومتريّة خاصّة بها. يرمز لهذه المركّبات بالأسلوب التالي: He@C60.
الاستخدامات

إنّ أكبر استهلاك للهيليوم هو استخدامه في تبريد أجهزة المغناطيس فائقة الموصلية المستخدمة في تقنيّات عدّة كالتصوير بالرنين المغناطيسي على سبيل المثال.
يستخدم الهيليوم في عدة مجالات وتطبيقات بما يتناسب مع خواصه المميّزة، مثل انخفاض نقطة غليانه وكثافته وانحلاليّته المنخفضة، بالإضافة إلى ناقليّته الحراريّة المرتفعة وخواصه الخاملة. بلغ الإنتاج العالمي من الهيليوم عام 2008 حوالي 32 مليون كغ (ما يعادل 193 مليون متر مكعّب)، وكان أكبر استهلاك له (حوالي 22%) في تبريد أجهزة المغناطيس فائق الموصلية المستخدمة في عدة تقنيّات مثل أجهزة التصوير بالرنين المغناطيسي. إنّ مصادم الهدرونات الكبير في سرن CERN يستخدم حوالي 96 طن متري من الهيليوم السائل للحفاظ على درجات حرارة دون 1.9 كلفن.
نتيجة خموله الكيميائي، يستخدم الهيليوم كغاز واقي في إنتاج رقائق السيليكون والجرمانيوم وفي إنتاج التيتانيوم والزركونيوم وفي الاستشراب الغازي. كما يستخدم الهيليوم كغاز واقي في عمليّات اللحام القوسي على المواد التي يؤدّي لحامها عند درجات حرارة مرتفعة إلى إشابتها أو إضعافها بالهواء أو بالنيتروجين. يستخدم الهيليوم عوضاً عن الأرغون للحام المواد التي لها ناقليّة حراريّة مرتفعة مثل الألمنيوم أو النحاس.

جهاز لكشف التسريبات باستخدام غاز الهيليومن ويكبيديا
من إحدى التطبيقات الصناعيّة لغاز الهيليوم استخدامه في كشف التسريب في الأجهزة التي تستخدم تفريغ مرتفع مثل الحاويات المستخدمة في التبريد العميق، وذلك لأن الهيليوم ينتشر في الأجسام الصلبة أسرع بثلاث مرات من الهواء. يوضع الجهاز المراد كشف التسريب فيه في حجرة تخلّى من الهواء وتملأ بالهيليوم، ويقاس الهيليوم الذي ينفد من مكان التسريب باستخدام أجهزة مخصصة لذلك. بالمقابل يمكن ملء الجهاز المراد كشف التسريب فيه بالهيليوم ويكشف عن مكان التسريب بجهاز يمرر يدويّاً على الجهاز بالكامل.

يستخدم الهيليوم في ملء المناطيد
لأنّ وزنه أخف من الهواء، يستخدم الهيليوم في ملء السفن الهوائية والمناطيد لتتمكّن من الطيران. على الرغم من أنّ الهيدروجين أخفّ من الهيليوم، لكنّه قابل للاشتعال، في حين أنّ الهيليوم لا يشتعل.
يدخل الهيليوم في تركيب غازات التنفس في أجهزة الغوص العميق، مثل تريمكس وهيليوكس، وذلك للتخفيف من الآثار التخديرية لغازات التنفس عند الضغوط المرتفعة. وجد أنّ الغوص إلى أعماق دون 150 متر باستخدام أجهزة تنفس أكسجين-هيليوم تؤدّي إلى حدوث رعاش واضطراب في الوظائف الحسّيّة الحركيّة، ممّا يعدّ مؤشّراً على حدوث أعراض متلازمة الضغط العالي العصبي، أو ما يعرف باسم رعاش الهيليوم. هذا الأثر يمكن أن يعود إلى حدّ ما نتيجة إضافة كمّيّات من غاز له خواص تخديريّة في الغطس مثل الهيدروجين أو النيتروجين إلى مزيج أكسجين-هيليوم. في أعماق كهذه، وجد أن الكثافة المنخفضة للهيليوم لها دور في تخفيف المجهود المبذول للتنفس.
استخدم ليزر هيليوم-نيون، وهو نوع من ليزر الغاز له طاقة منخفضة، وذلك من أجل إنتاج حزمة حمراء اللون، وذلك في عدّة تطبيقات مثل قارئ الشفرة الخيطية ومؤشر الليزر، وذلك قبل أن يستبدل بليزر الصمام الثنائي.
يستخدم الهيليوم كوسط لتبادل الحرارة في بعض المفاعلات النوويّة المبرّدة بالغاز وذلك بسبب خموله الكيميائي وبسبب ناقليّته الحراريّة العاليّة، وعدم تأثره بالنيوترونات، ولعدم تشكيله نظائر مشعّة تحت شروط عمل المفاعل.
عند مزج الهيليوم مع غاز أثقل مثل الزينون فإنّه يستخدم في المحركات الصوتيّة الحراريّة المستخدمة في التبريد، وذلك نتيجةً لارتفاع نسبة السعة الحرارية الناتجة ولانخفاض عدد برانتل. إنّ خمول غاز الهيليوم له آثار إيجابيّة على البيئة مقابل أنظمة التبريد التقليديّة التي تؤدي إلى نضوب الأوزون والاحترار العالمي.
إنّ استعمال الهيليوم يقلّل من الآثار المشوّشة في بعض المقاريب، والتي تحصل نتيجة تفاوت درجة الحرارة في الفراغ بين العدسات، وذلك بسبب الانخفاض الكبير لقيمة قرينة الانكسار بالنسبة للهيليوم.تعد هذه طريقة عملية بالنسبة للمقاريب الشمسية التي تكون بحاجة إلى استخدام أنبوب تفريغ والذي غالباً ما يكون ثقيل الوزن.
الاستنشاق وإجراءات الأمان
الآثار
إنّ الهيليوم في الشروط العادية عبارة عن غاز غير سام وليس له تأثير حيوي على جسم الإنسان عند التعرّض له. ولكن عندما يستنشق الهيليوم عن طريق الفم فإنّ له تأثير على الحبال الصوتيّة بحيث يظهر الصوت كأنه مُسرّع. سبب هذا الأثر أنّ سرعة الصوت في الهيليوم أسرع منها بثلاث مرات من الهواء. بما أنّ التردّد الأساسي لتجويف مملوء بغاز متناسب مع سرعة الصوت في هذا الغاز، لذلك فإنّه عندما يستنشق الهيليوم فإنّ هنالك ازدياد في رنين المجرى الصوتي. إنّ تردّدات الرنين العالية تسبّب اختلاف في طابع الصوت بحيث يظهر متسارعاً (مزقزق، كما يعرف أحياناً باسم صوت ميكي ماوس).إنّ التأثير المعاكس بتخفيض تردّد الرنين يمكن الحصول عليه باستنشاق غاز كثيف مثل سداسي فلوريد الكبريت أو الزينون.
المخاطر
إنّ المبالغة في استنشاق الهيليوم لتحقيق أثره على الحبال الصوتيّة يمكن أن يكون خطراً، حيث يؤدّي إلى الاختناق لأنّه يحلّ محلّ الأكسجين اللازم لعمليّة التنفّس. سجّلت حالات وفاة ناتجة عن المبالغة في استنشاق الهيليوم، من بينهم أطفال وبالغين.
إنّ استنشاق الهيليوم مباشرةً من الأسطوانات المضغوطة خطر جداً، حيث يمكن أن يؤدّي إلى حدوث رضح ضغطي نتيجة معدّل السرعة العالي للهيليوم المتدفّق، والذي يمكن أن ينجم عنه تمزّق مميت لأنسجة الرئتين.
ينبغي اتّباع إجراءات الأمان اللازمة عند التعامل مع الهيليوم السائل، لأنّ درجة الحرارة المنخفضة يمكن أن تؤدّي إلى عضة برد. كما ينبغي الانتباه إلى ضرورة ضبط الضغط لأنّ نسبة تمدد السائل-إلى-الغاز المرتفعة يمكن أن تؤدّي إلى حدوث انفجارات إن لم يكن هناك صمّامات ضغط متوفّرة.








 .. ويحدد عزم المدار الزاوي.
.. ويحدد عزم المدار الزاوي. . ويحدد هذا الرقم إزاحة الطاقة
. ويحدد هذا الرقم إزاحة الطاقة  .
. (راجع بالأسفل لمعرفة نظام الكتابة)
(راجع بالأسفل لمعرفة نظام الكتابة)  .
.  .
.  .
.  ) بوجود المدار n=3، وعلى هذا فإنه يتم تجاهل التوزيع الإلكتروني للنيون ويكتب التوزيع الإلكتروني للفسفور كالتالي : [Ne] 3 s 2 3 p 3 {\displaystyle 3s^{2}3p^{3}}
) بوجود المدار n=3، وعلى هذا فإنه يتم تجاهل التوزيع الإلكتروني للنيون ويكتب التوزيع الإلكتروني للفسفور كالتالي : [Ne] 3 s 2 3 p 3 {\displaystyle 3s^{2}3p^{3}}  .
. 




 , وليس [Ar] 4 s 2 3 d 9 {\displaystyle 4s^{2}{\mbox{ }}3d^{9}}
, وليس [Ar] 4 s 2 3 d 9 {\displaystyle 4s^{2}{\mbox{ }}3d^{9}}  ، كما قد يتوقع طبقا لقاعدة أوف باو. وبالمثل
، كما قد يتوقع طبقا لقاعدة أوف باو. وبالمثل  , وليس [Ar] 4 s 2 3 d 4 {\displaystyle 4s^{2}{\mbox{ }}3d^{4}}
, وليس [Ar] 4 s 2 3 d 4 {\displaystyle 4s^{2}{\mbox{ }}3d^{4}}  .
.







